1. Mecanismo de reacción
Una reacción química ocurre en una etapa o, más frecuentemente, mediante una secuencia de varias etapas.
Los mecanismos de reacción son la secuencia de pasos que siguen los reactivos de una reacción, para transformarse en productos. Y estas reacciones químicas ocurren con ruptura y formación de enlaces, a diferen tes velocidades.
Unas reacciones son instantáneas, otras requieren minutos, horas o días.
Es procedente recordar que las reacciones orgánicas a temperatura ambiente son lentas y de bajo rendimien to pero a temperatura superior a la ambiental; van desde rápidas hasta explosivas.
Una reacción puede ocurrir en una etapa o, más frecuentemente, por una secuencia de varias etapas. Por ejemplo, A + B ➝ X + Y puede producirse en dos etapas:
(1) A ➝ I + X seguido por (2) B + I ➝ Y
Sustancias como I. formada en la primera etapa y consumida en otra, se denominan intermediarios. En ocasiones los mismos reactivos pueden dar productos a través de mecanismos diferentes. Los mecanismos de reacción se pueden realizar por intermedios iónicos y por radicales libres.
2. Ruptura en los enlaces covalentes
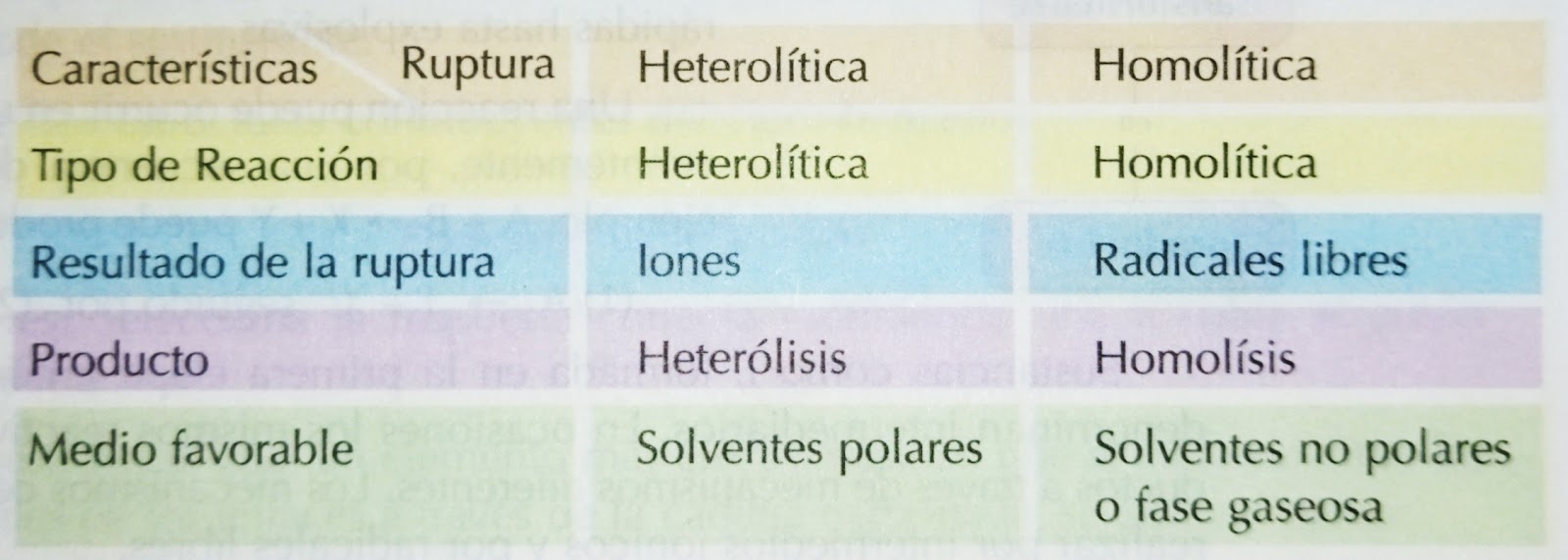
Los intermedios que contienen carbono pueden surgir de dos tipos de ruptura de enlace: ruptura heterolitica (polar) y ruptu ra homolitica (radical).
Ruptura heterolitica (polar): Ambos electrones quedan en uno de los fragmentos; por ejemplo:
A : B ➝ A⁺: B⁻ o también A : B ➝ A⁻ : + B⁺
Como se puede apreciar, en ambos casos se forman iones.
En este caso se produce una heterólisis y la reacción se llama heterolitica.
Los iones donde el carbono presenta un par de electrones sin compartir se llaman carbaniones y los que presentan deficiencia de electrones se llaman carbonios.
Ruptura homolitica (radical): Cada uno de los fragmentos que se separa conserva un electrón; por ejemplo:
La reacción producida se llama homolítica y las especies químicas que resultan reciben el nombre de radicales libres debido a que poseen un electrón desapareado y presentan una elevada reactividad.
Las reacciones heteroliticas se realizan más satisfactoriamente en el seno de solventes polares mientras que las reacciones homoliticas se producen en presencia de solventes no polares.
Las reacciones homolíticas suelen presentarse en las reacciones en fase gaseosa o aquellas que ocurran en presencia de solventes no polares y catalizados por acción de la luz o por adición de otros radicales libres.
A continuación se presenta un cuadro comparativo contentivo de las características de la ruptura heterolítica y la ruptura homolítica:
3. Reactivos nucleofílicos y electrofílicos
Un reactivo nucleofílico es el que posee una estructura con exceso de electrones y es capaz de donar electrones para formar un enlace. Los reactivos nucleofílicos pueden ser aniones o moléculas neutras. Son ejemplos de reactivos nucleofílicos, los siguientes:
Un reactivo electrofílico es el que posee una estructura con deficiencia de electrones y puede compartir un par de electrones para formar un enlace con otra estructura. Los reactivos electrofilicos pueden ser cationes o moléculas neutras.
Son ejemplos de reactivos electrofilicos los siguientes
Los reactivos electrofílicos y nucleofílicos se comportan de manera general como ácidos y bases de Lewis. Siguiendo el criterio de Lewis, bases son estructuras que suministran un par de electrones para formar un enlace y ácidas estructuras que captan un par de electrones para formar un enlace.
A continuación se presenta un resumen de las características de los reactivos nucleofílicos y electrofílicos.
Las reacciones químicas en las cuales intervienen compuestos orgánicos se pueden clasificar en cuatro tipos: reacciones de adición, de sustitución o desplazamiento, de eliminación y de reordenamiento interno.
En las reacciones de adición aumenta el número de átomos o grupos unidos a un carbono. Es un tipo de reacción característico de los enlaces múltiples (doble o triple). Por ejemplo:
En las reacciones de sustitución se reemplaza un átomo o grupos unidos a un carbono por otro. Es característica de compuestos saturados y de los anillos aromáticos. Por ejemplo:
Las reacciones de eliminación son opuestas a las reacciones de adición y consisten en la disminución en el número de átomos o grupos unidos al carbono. En estas reacciones se forman compuestos insaturados de doble o triple enlace. Por ejemplo:
En las reacciones de reordenamiento interno o reagrupamiento se produce la transformación de un compuesto en otro sin que se origine ganancia o pérdida de materia. Un ejemplo típico es la conservación de cianato de amonio en urea.
En algunos tipos de reacciones es procedente denominar a uno de los reactivos como agente atacante y al otro el sustrato Por lo general, el sustrato es una molécula orgánica
Cuando ambos reactivos son orgánicos aquel que suministra el carbono al nuevo enlace se considera como el sustrato. Cuando se forman enlaces carbono-carbono, la selección del agente atacante y del sustrato es un tanto arbitraria.
Los agentes atacantes se clasifican según si ellos suministran un par de electrones al sustrato, o a la inversa, el sustrato le suministra el par de electrones. De acuerdo con esto podemos plantear que hay dos tipos de agentes atacantes: reactivos nucleofilicos y reactivos electrofilicos, los cuales fueron desarrollados en el numeral 3 del presente capitulo.
PREGUNTAS DE CONTROL
1. Define mecanismo de reacción ¿De qué se necesita disponer para establecer un mecanismo completo?
2 Explica las rupturas homoliticas y heterolíticas.
3. ¿Qué son agente atacante y sustrato? ¿Cómo se pueden diferenciar?
4. Define lo que es un reactivo nucleofílico. ¿Qué región de una molécula atacan con facilidad?. Escribe 3 agentes nucleofilicos que sean iones y 3 que sean moléculas neutras.
5. La misma pregunta anterior pero referida a un agente electrofilico.
6. ¿Qué es una reacción de adición?. Ejemplifícala totalmente completando la reacción:
7. Se tiene la siguiente reacción:
b) Explica el mecanismo
c) ¿Qué tipo de reacción de adicion es?
8. Define lo que es una reacción de sustitución. Ejemplificala completando la siguiente reacción:
9. Ejemplifica la reacción E₂ completando y balanceando la siguiente reacción.
11. ¿Qué es tautimería? Ejemplificalo completando la siguiente reacción:



















😊
ResponderBorrar😃
ResponderBorrar🤙🏻
ResponderBorrarFino
ResponderBorrar